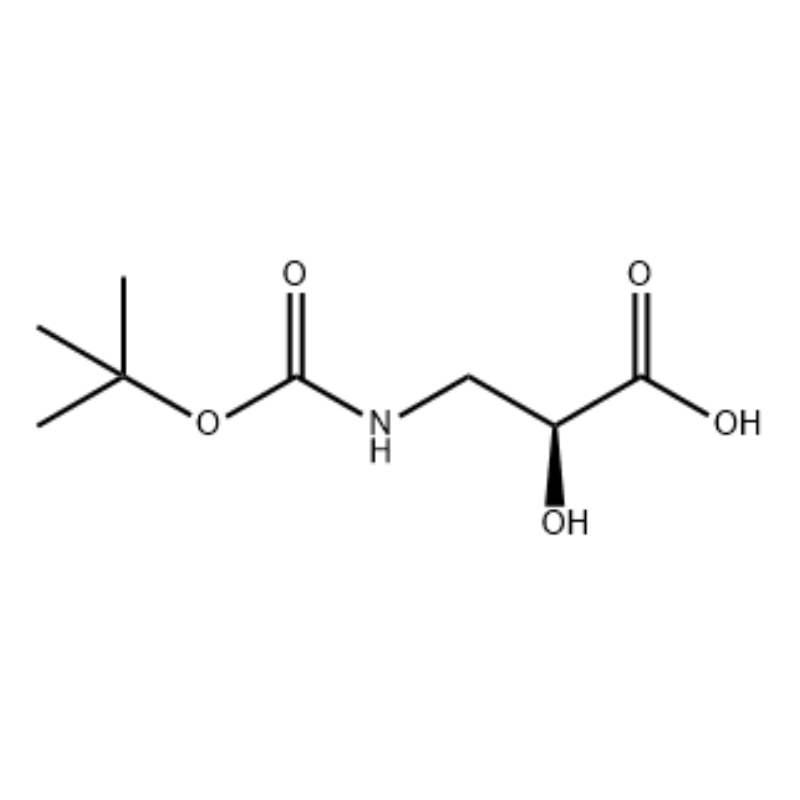
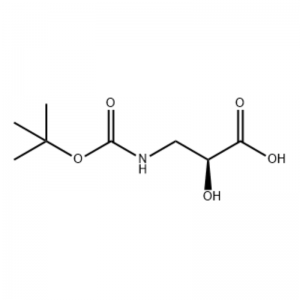
(S)-isoserina 15a (21 g, 0,20 mol) foi dissolvida em tetrahidrofurano (100 mL) e um solvente misto de solução aquosa de hidróxido de sódio a 10% (100 mL), dicarbonato de di-terc-butila (50 mL, 0,22 mol) foi adicionado gota a gota. A reação foi realizada à temperatura ambiente durante 9 horas. A fase aquosa foi ajustada para pH 2 com ácido clorídrico 4 mol/L e extraída com diclorometano/metanol (v/v = 5/1, 50 mL x 3 ) e seco sobre sulfato de sódio anidro. Filtrar por sucção, concentrar sob pressão reduzida. O composto do título 15b foi obtido como um óleo incolor (35 g, rendimento: 85 por cento).
A uma solução agitada de S-isoserina (4,0 g, 0,038 mol) em dioxano: H2O (100 mL, 1:1 v/v) a 0°C foi adicionada N-metilmorfolina (4,77 mL, 0,043 mol), seguida por BoC2O (11,28 mL, 0,049 mol) e a reação foi agitada durante a noite com aquecimento gradual até à temperatura ambiente.Glicina (1,0 g, 0,013 mol) foi então adicionada e a reação foi agitada durante 20 min.A reação foi resfriada a 0°C e sat.Foi adicionado NaHCO3 (75 mL).A camada aquosa foi lavada com acetato de etil (2 x 60 mL) e depois acidificada até pH 1 com NaHSO4.Esta solução foi então extraída com acetato de etila (3 x 70 mL) e estas camadas orgânicas combinadas foram secas sobre Na2SO4, filtradas e concentradas até à secura para dar o ácido N-Boc-3-ammo-2(S)-hidroxi-propanóico desejado. (6,30 g, 0,031 mmol, 81,5 por cento de rendimento): RMN de 1H (400 MHz, CDC13) δ 7,45 (sl, 1 H), 5,28 (sl, 1 H), 4,26 (m, 1 H), 3,40-3,62 (m , 2H), 2,09 (s, 1H), 1,42 (s, 9H);RMN de 13C (100 MHz, CDC13) δ 174,72, 158,17, 82, 71,85, 44,28, 28,45.
ácido N-Boc-3-amino-2(S)-hidroxi-propiónico;A uma solução agitada de S-isoserina (4,0 g, 0,038 mol) em dioxano: H2O (100 mL, 1:1 v/v) a 0°C foi adicionada N-metilmorfolina (4,77 mL, 0,043 mol), seguida por BoC2O (11,28 mL, 0,049 mol) e a reação foi agitada durante a noite com aquecimento gradual até à temperatura ambiente.Glicina (1,0 g, 0,013 mol) foi então adicionada e a reação foi agitada durante 20 min.A reação foi resfriada a 0°C e solução aquosa sat.Foi adicionado NaHCO3 (75 mL).A camada aquosa foi lavada com acetato de etil (2 x 60 mL) e depois acidificada até pH 1 com NaHSO4.Esta solução foi então extraída com acetato de etila (3 x 70 mL) e estas camadas orgânicas combinadas foram secas sobre Na2SO4, filtradas e concentradas até à secura para dar o ácido N-Boc-3-amino-2(5)-hidroxi-propanóico desejado. (6,30 g, 0,031 mmol, 81,5 por cento de rendimento): RMN de 1H (400 MHz, CDC13) δ 7,45 (sl, 1 H), 5,28 (sl, 1 H), 4,26 (m, 1 H), 3,40-3,62 (m , 2H), 2,09 (s, 1H), 1,42 (s, 9H);RMN de 13C (100 MHz, CDC13) δ 174,72, 158,17, 82, 71,85, 44,28, 28,45.
 Edifício 12, No.309, South 2nd Road, Zona de Desenvolvimento Econômico, Distrito de Longquanyi, Chengdu, Sichuan, China.
Edifício 12, No.309, South 2nd Road, Zona de Desenvolvimento Econômico, Distrito de Longquanyi, Chengdu, Sichuan, China. amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com
amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com +86 (028) 84841969
+86 (028) 84841969 +86 135 5885 5404
+86 135 5885 5404











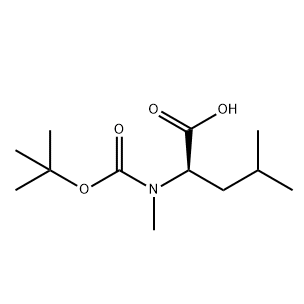






.png)


